4 Minuten
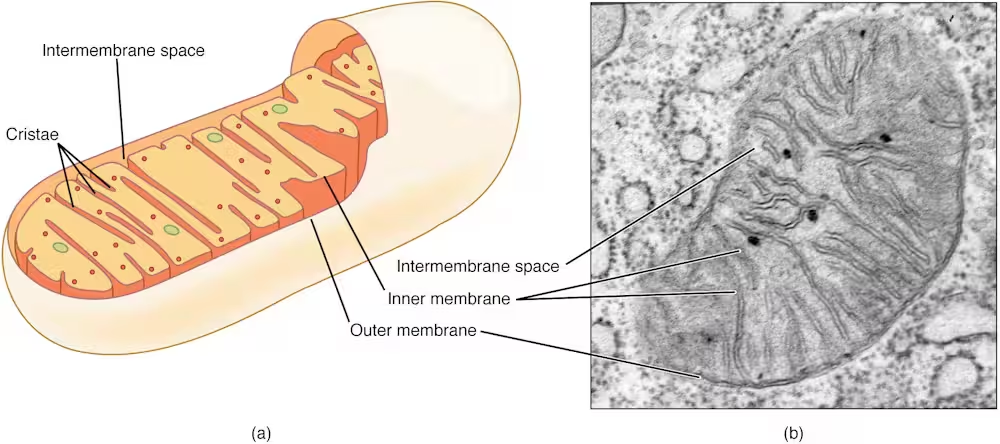
Die evolutionäre Funktion der Mitochondrien als Energieversorger der Zelle ist in Biologiebüchern weithin bekannt. Doch aktuelle Forschungen zeichnen ein erweitertes Bild: Mitochondrien sind weit mehr als bloße biologische Kraftwerke. Neue Studien belegen, dass Mitochondrien eine zentrale Rolle im Immunsystem spielen und maßgeblich beeinflussen, wie effektiv unser Körper bakterielle Bedrohungen erkennt und abwehrt.
Die wachsende Bedeutung der Mitochondrien für die zelluläre Immunität
Lange Zeit galten Mitochondrien vor allem als Produzenten von ATP, dem Hauptenergieträger der Zelle. Die moderne Zellbiologie zeigt jedoch, dass sie auch komplexe Immunabwehrmechanismen steuern. Mitochondrien regulieren Entzündungsprozesse, Apoptose (programmierter Zelltod) und schnelle Reaktionen auf mikrobielle Angriffe. Damit sind sie unverzichtbar für die angeborene Immunabwehr.
Jüngste Forschungen von Immunologinnen und Immunologen haben eine bisher unbekannte Funktion aufgedeckt: Mitochondrien agieren als Sensoren innerhalb weißer Blutkörperchen, insbesondere in Neutrophilen. Sie erkennen bakterielle Stoffwechselprodukte und aktivieren entsprechend antimikrobielle Verteidigungsmechanismen. Das Verständnis dieser Verbindung zwischen Zellstoffwechsel und Immunantwort fördert das neue Forschungsfeld der Immunmetabolismus, das untersucht, wie Stoffwechselprozesse die Immunfunktionen auf molekularer Ebene steuern.
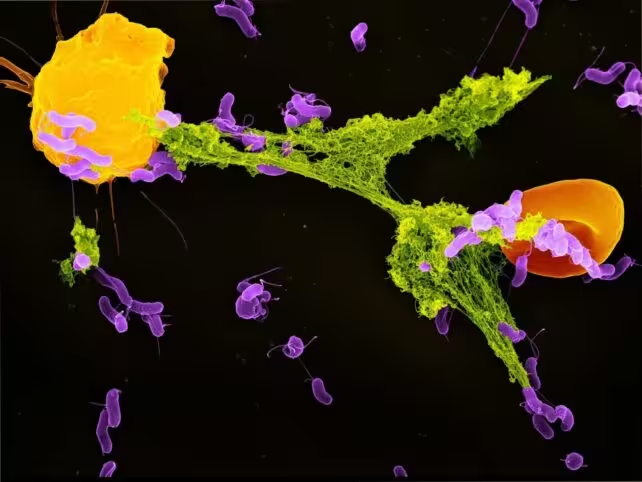
Wie Neutrophile und Mitochondrien gemeinsam Bakterien bekämpfen
Neutrophile sind die häufigsten weißen Blutkörperchen des Menschen und bilden die erste Verteidigungslinie gegen bakterielle Eindringlinge. Ein besonderer Abwehrmechanismus ist die Ausschleusung sogenannter neutrophiler extrazellulärer Fallen (NETs). Diese NETs bestehen aus DNA-Netzen, die mit antimikrobiellen Proteinen besetzt sind – sie fangen eindringende Mikroben physisch ein und behindern deren Ausbreitung im Körper.
Bisher ging man davon aus, dass NETs vor allem als Reaktion auf unspezifischen Zellstress gebildet werden. Neuere Studien zeigen jedoch, dass ein gezielterer Mechanismus existiert: Mitochondrien in Neutrophilen erkennen Laktat – ein Stoffwechselprodukt, das viele Bakterien während Infektionen freisetzen. Während Laktat beim Menschen meist mit Muskelerschöpfung assoziiert wird, signalisiert es im Kontext der Immunabwehr eine aktive bakterielle Stoffwechselaktivität.
Werden Bakterien von Neutrophilen in Phagosomen – speziellen Zellkompartimenten – eingeschlossen, können die Mitochondrien das von den Bakterien freigesetzte Laktat erkennen. Dieses Signal veranlasst die Mitochondrien, die Bildung von NETs anzustoßen und so Bakterien einzufangen. Ist diese mitochondriale Sensorik gestört, sinkt die NET-Produktion, Bakterien können sich leichter ausbreiten – ein entscheidender Schwachpunkt in der Immunabwehr. Dieser Prozess ist ein Paradebeispiel für die komplexe Interaktion zwischen bakterieller Aktivität und dem zellulären Stoffwechsel des Wirts und unterstreicht die Bedeutung der Immunmetabolismus-Forschung.
Wissenschaftliche Implikationen: Mitochondriale Funktionsstörungen und Krankheitsanfälligkeit
Diese Erkenntnisse sind besonders relevant, um zu erklären, warum bestimmte Menschen, etwa mit Autoimmunerkrankungen wie systemischem Lupus erythematodes (SLE), anfälliger für wiederkehrende und schwere Infektionen sind. Forschungen zeigen, dass Neutrophile bei Lupus-Patienten häufig funktionsgestörte Mitochondrien aufweisen, die das bakterielle Laktat schlechter erkennen und NETs weniger effizient bilden. Trotz einer überaktiven Immunlage bleibt die antibakterielle Wachsamkeit reduziert – ein Paradoxon, das durch mitochondriale Fehlfunktionen erklärt wird.
Diese Entdeckung schlägt eine Brücke zwischen den Hauptproblemen der Immunologie: einerseits Überaktivität des Immunsystems (wie bei Autoimmunität), andererseits Immunschwäche (mit erhöhtem Infektionsrisiko). Gesunde Mitochondrien koordinieren präzise Abwehrreaktionen; defekte Mitochondrien stören dieses Gleichgewicht und führen entweder zu überschießenden Entzündungen oder zu einer erhöhten Anfälligkeit für Krankheitserreger.
Therapeutische Perspektiven: neue Ansätze durch gezielte Mitochondrien-Therapie
Das Wissen, dass Mitochondrien als essenzielle Sensoren für Infektionssignale dienen, eröffnet neue Möglichkeiten in der Medizin. Arzneistoffe, die die mitochondriale Sensorfunktion stärken, könnten die NET-Antwort und damit die Immunabwehr bei immungeschwächten Patienten verbessern. Hingegen könnten zielgerichtete Hemmungen dieser Signalwege in Fällen mit überschießender NET-Bildung – etwa bei schwerem COVID-19 oder bestimmten Autoimmunerkrankungen – helfen, Gewebeschäden durch exzessive Immunreaktionen zu verhindern.
Diese Forschung wirft zudem neue Fragen auf: Nutzen auch andere Immunzellen ähnliche Mechanismen zur Erkennung von krankheitsauslösenden Metaboliten? Welche anderen mikrobielle Stoffwechselprodukte spielen eine Rolle bei der Immunaktivierung oder -hemmung? Ein tieferes Verständnis dieser zellulären Signalnetzwerke könnte die Entwicklung maßgeschneiderter Immuntherapien ermöglichen, die Nebenwirkungen minimieren und gleichzeitig den Schutz vor Infektionen maximieren.
Die Forschungen zur Immunmetabolismus zeigen immer deutlicher: Mitochondrien sind keine passiven Energielieferanten. Vielmehr agieren sie als zelluläre Wächter, die feinste biochemische Hinweise einfangen, bakterielle Bedrohungen rechtzeitig erkennen und die koordinierte Immunantwort einleiten.
Fazit
Zusammengefasst sind Mitochondrien entscheidende Akteure im Zusammenspiel von Zellstoffwechsel und Immunabwehr. Diese Organellen wirken nicht nur als Kraftwerke, sondern auch als Immunwächter, die bestimmen, wie Neutrophile und andere Immunzellen bakterielle Herausforderungen registrieren und darauf reagieren. Das neue Verständnis der mitochondrialen Funktion erweitert unser Wissen über die menschliche Biologie grundlegend und eröffnet innovative Ansätze in der Präzisionsmedizin – bei Infektionskontrolle ebenso wie bei Autoimmunerkrankungen. Die fortschreitende Erforschung des Immunmetabolismus verspricht weitere Einblicke in die dynamischen Partnerschaften, die unsere Gesundheit auf mikroskopischer Ebene schützen.

Kommentare